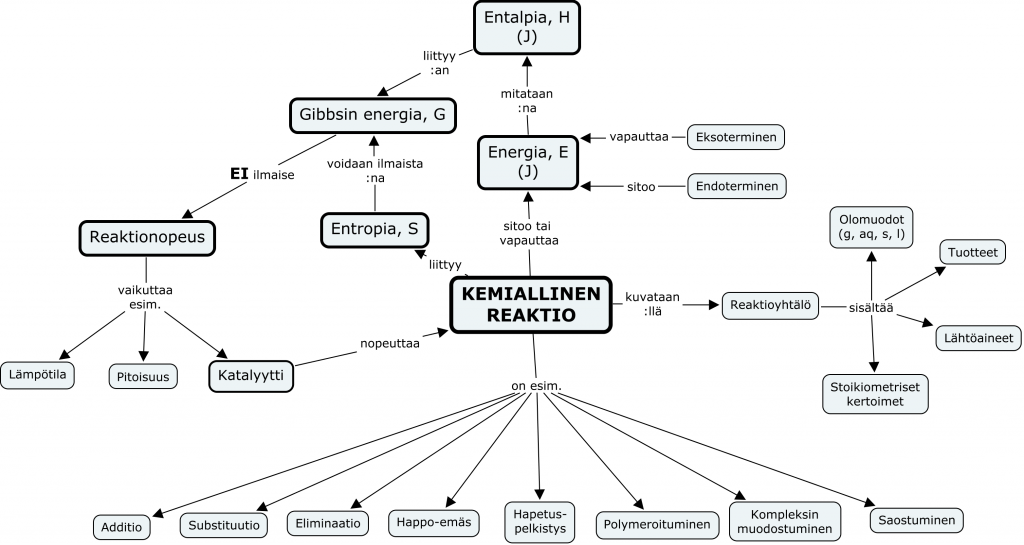
Käsitekartta kurssin asioista
Tavoitteet
Kurssin tavoitteena on, että opiskelija
- ymmärtää kemiallisen reaktion tapahtumiseen vaikuttavia tekijöitä sekä niiden merkityksen elinympäristössä (teollisuus)
- ymmärtää energian sitoutumisen ja vapautumisen kemiallisissa reaktioissa sekä niiden merkityksen yhteiskunnassa
- osaa kirjoittaa reaktioyhtälöitä ja käsitellä reaktioita matemaattisesti
- osaa tutkia kokeellisesti ja erilaisia malleja käyttäen reaktioihin, reaktionopeuteen ja -mekanismeihin liittyviä ilmiöitä.
Keskeiset sisällöt
- kemiallisen reaktion symbolinen ilmaisu
- epäorgaanisia ja orgaanisia reaktiotyyppejä, mekanismeja sekä sovelluksia
- stoikiometrisia laskuja, kaasujen yleinen tilanyhtälö
- energianmuutokset kemiallisessa reaktiossa
- reaktionopeus ja siihen vaikuttavat tekijät
Tämä Opetus tv on aivan mahtava juttu! Luen pääsykokeisiin ja mun silmät on niin kipeet etten pysty tänään lukemaan… Ihan oikeesti! Ratkaisuna siis Opetus Tv! Kiitos tekijöille, pelastitte mun päivän! 😀
Kiitoksia vaan palautteesta ja tsemppiä kokeisiin!
T:Samuli
Pakko vielä todeta: Onko Kemian ja Fysiikan opiskelu ollut koskaan näin hauskaa? -Moottorisänky, Opetus tv pyörimään Apple tv:n kautta ja kasa herkkuja. Kyllä kelpaa! 😀
Tuo moottorisänky kuulostaa luksukselta 😉 Toivottavasti oppimista tapahtuu herkkujen syönnin lomassa.Cheers!
Heippa taas. Saisiko täältä vastaukse seuraavaan ongelmaa. Lukion kirjoissa määritellään kondensaatio reaktio, että kadesta molekyylista muodostuu kaksi molekyyliä, joista toinen on YLEENSÄ vesi ja hydrolyysi siten, että se on kondensaation käänteisreakti eli kahdesta molekyylistä tulee molemmissa reaktioissa kaksi molekyyliä. Millä ihmeellä erotan kumpi on kyseessä jos kondensaatiossa ei muodostukaan vettä?
Kondensaatio on tosiaan reaktio, jossa sivutuotteena muodostuu jokin pieni molekyyli. Usein tämä molekyyli on vesi (vrt. esterin muodostuminen), mutta voi olla myös esimerkiksi HCl.
Hydrolyysi on kondensaatiolle vastakkainen reaktio, mutta ainoastaan veden tapauksessa.
Ok, tätä lukion kirja ei kerro, mutta arvasin, että tähänkin ongelmaan saan vastauksen täältä. Kiitos taas. Eli kaksi molekyyliä reagoi ja syntyy kaksi uutta molekyylia = kondensaatio. Molekyyli ja vesi reagoi ja syntyy kaksi uutta molekyylia = hydrolyysi. Ymmärsinkö oikein?
Juuri näin!
Kysymys: Kuinka monta litraa typpeä syntyy 250 grammasta natriumatsidia? Vastaus: 129 dm³. Mutta miten se lasketaan? Haen siis ”haihtumisen” laskukaavaa.
Kiitos!
Olen miettinyt tätä laskua nyt kaksi päivää, mutta tästä ei tule mitään. Saisko täältä apua tähän tehtävään: Kupari(I)oksidia syntyy, kun kupari ja happi reagoivat keskenään. Kirjoita tasapainotettu reaktioyhtälö ja laske kupari(I)oksidin teoreettinen saanto, kun 15,0 g kuparia reagoi.
Kysymys:
Kupari(I)oksidia syntyy, kun kupari ja happi reagoivat keskenään. Kirjoita tasapainotettu reaktioyhtälö ja laske kupari(I)oksidin teoreettinen saanto, kun 15,0 g kuparia reagoi.